
科目: 来源: 题型:选择题
| A. | ①② | B. | ⑤⑥ | C. | ④⑥ | D. | ③⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,则滤液中: c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 40℃时,在氨水体系中不断通入CO2,随着CO2的通入,$\frac{c(OHˉ)}{c(NH3•H2O)}$不断增大 | |
| C. | 室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入0.05molCaO,所得溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(NH4+)相等的NH4Cl溶液中的c(Cl-)大于(NH4)2Fe(SO4)2溶液中c(SO42-) | |
| B. | 常温下,pH=1的醋酸与pH=13的NaOH 溶液混合后的溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中 2c(Na+)═3c(CO32-)+3c(HCO3-) | |
| D. | 稀释氯化铵溶液过程中,NH4+的水解程度和水的电离程度都增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 18g D216O中含有的中子数为9NA | |
| B. | 1molCH3COONa和少量CH3COOH溶于水形成的中性溶液中,CH3COO-数目小于NA | |
| C. | 常温常压下,甲醛和冰醋酸的混合物共6.0g,其中含有的原子总数为0.8NA | |
| D. | 将1molCH3CH2OH催化氧化为CH3COOH,消耗的O2分子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-) | |
| B. | 若向溶液中不断加水稀释,水的电离程度增大 | |
| C. | 若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a | |
| D. | 若向该溶液中加入等体积CaCl2溶液后能够产生沉淀,则CaCl2溶液的最小浓度应该大于2.4×10-8 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| B. | 通常情况下,32g O2和O3的混合气体含有的分子总数小于NA | |
| C. | 6.4g CaC2中含有的离子总数目为0.3NA | |
| D. | 标准状况下,将分子总数为NA的NH3和Cl2充分混合后,所得混合气体体积约为22.4L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由W与X组成的化合物的沸点总高于由W与Y组成的化合物的沸点 | |
| B. | 以上四种元素的原子半径大小为W<X<Y<Z | |
| C. | W、X、Y、Z原子的核外最外层电子数的总和为23 | |
| D. | W 与 Y 可形成离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
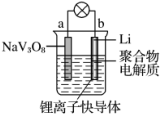 水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )
水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 该电池可以用硫酸钠溶液作电解质 | |
| C. | 充电过程中阳极的电极反应式:NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 充电过程中Li+从阳极向阴极迁移 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 12g 金刚石中含有的六元碳环数为NA | |
| B. | 1L1mol/L 的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 12g 石墨和 C60的混合物中质子总数为6NA | |
| D. | 反应 KIO3+6HI=KI+3H2O+3I2中,生成1molI2转移电子的总数为2NA |
查看答案和解析>>
科目: 来源: 题型:实验题
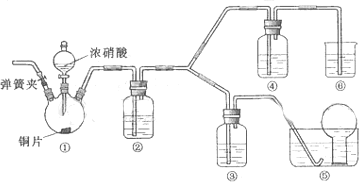
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com