
科目: 来源: 题型:实验题
| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 与水混溶 |
| 甲醛 | -21 | 与水混溶 |
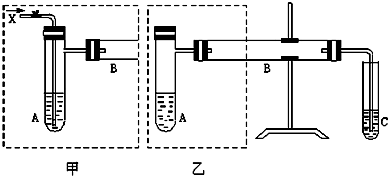
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
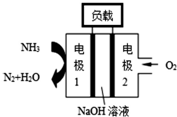 ①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.
①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.查看答案和解析>>
科目: 来源: 题型:填空题
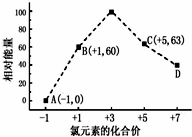 一定条件下,在水溶液中1mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如图所示.回答下列问题:
一定条件下,在水溶液中1mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如图所示.回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
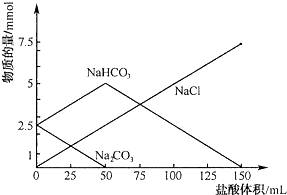
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
 ④CH3COOH⑤HOCH2CHO ⑥CH3CH2CH2CH3⑦葡萄糖 ⑧蛋白质⑨淀粉
④CH3COOH⑤HOCH2CHO ⑥CH3CH2CH2CH3⑦葡萄糖 ⑧蛋白质⑨淀粉查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 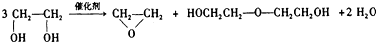 | |
| B. | 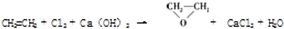 | |
| C. |  | |
| D. | 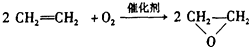 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com