
科目: 来源: 题型:选择题
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 医用消毒酒精中乙醇的浓度为75% | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 糖类、油脂和蛋白质均为高分子化合物,均可发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 | |
| B. | 可以用澄清石灰水鉴别CO2和SO2 | |
| C. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| D. | 大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C、N、O最高正价依次升高 | B. | 钠、镁、铝的还原性依次减弱 | ||
| C. | HC1、HBr、HI的稳定性依次增强 | D. | H3PO4、H2SO4、HC1O的酸性依次增强 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯和溴水在铁作催化剂下发生反应: +Br$\stackrel{Fe}{→}$ +Br$\stackrel{Fe}{→}$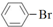 +HBr +HBr | |
| B. | 乙二醛(OHC-CHO)与银氨溶液反应:OHC-CHO+4Ag(NH3)2OH$\frac{\underline{\;\;△\;\;}}{\;}$(NH4)2C2O4+4Ag↓+2H2O+6NH3 | |
| C. | 蔗糖水解生成葡糖糖:C12H22O11+H2O$\underset{\stackrel{稀硫酸}{→}}{△}$2C6H12O6(葡糖糖) | |
| D. | 乙二醇与硬脂酸酯化可以生成硬脂酸甘油酯: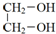 +2C17H35COOH$→_{△}^{浓硫酸}$ +2C17H35COOH$→_{△}^{浓硫酸}$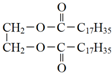 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1查看答案和解析>>
科目: 来源: 题型:选择题
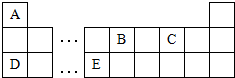
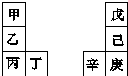 甲~辛等元素在周期表中的相对位置如表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>戊>己 | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com