
科目: 来源: 题型:解答题
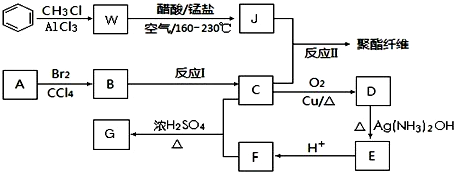
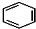 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$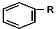 +HCl(-R为烃基)
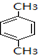
+HCl(-R为烃基)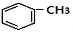 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$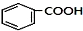
 .
.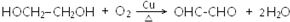 .
.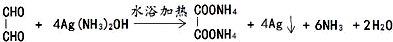 .
.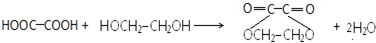 .
.查看答案和解析>>
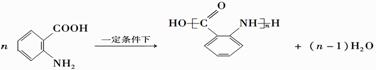
科目: 来源: 题型:解答题
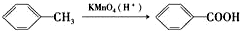
 (苯胺,易被氧化)
(苯胺,易被氧化)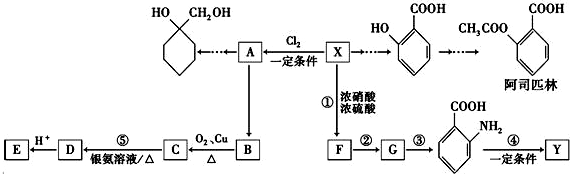
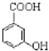 的名称为邻羟基苯甲酸,G中的官能团名称为硝基、羧基.
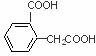
的名称为邻羟基苯甲酸,G中的官能团名称为硝基、羧基.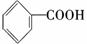 ;
; ;
; 、
、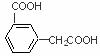 、
、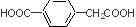
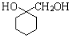 的合成路线流程图 (无机试剂任用).
的合成路线流程图 (无机试剂任用).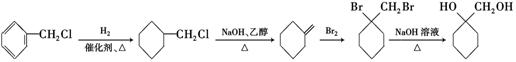 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除⑤外 | B. | 仅④⑤ | C. | 仅①②③ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:解答题
 的化学方程式:
的化学方程式: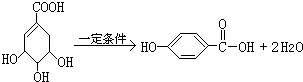 .
.查看答案和解析>>
科目: 来源: 题型:填空题
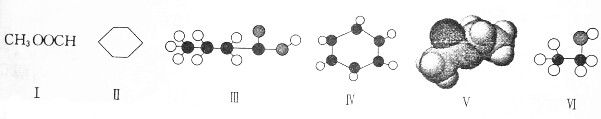
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定条件下,180g淀粉水解得到葡萄糖的分子数为NA | |
| B. | 1 mol C10H22分子中共价键总数为31 NA | |
| C. | 室温下,4.4 g乙醛和乙酸乙酯的混合物含有的碳原子数为0.2 NA | |
| D. | 88.0g干冰中含有的共用电子对对数为8NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ⑧② | B. | ⑥①⑤③ | C. | ④② | D. | ⑦①③ |
查看答案和解析>>
科目: 来源: 题型:解答题
| M(OH)n | KSP | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-52 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-38 | 5.9 | 8.9 |
查看答案和解析>>
科目: 来源: 题型:解答题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-15 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com