
科目: 来源: 题型:实验题
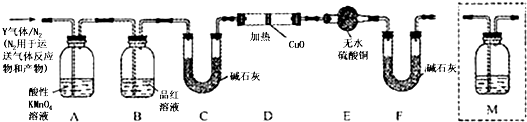
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:推断题
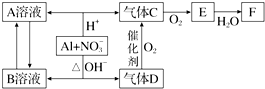
查看答案和解析>>
科目: 来源: 题型:推断题
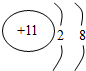 .
.查看答案和解析>>
科目: 来源: 题型:实验题

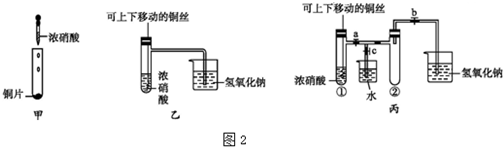
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生成的气体在标准状况下的体积为4.48 L | |
| B. | 硝酸只起到强氧化性作用 | |
| C. | 被还原的硝酸的物质的量为(0.2-a) mol | |
| D. | 反应后溶液中所含NO3-的物质的量为0.2 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据金属失去电子的多少来判断,失去电子较多的金属性较强 | |
| B. | 用钠置换MgCl2溶液中的Mg2+,来验证钠的金属性强于Mg | |
| C. | Mg不与NaOH溶液反应而Al能与NaOH溶液反应,可说明金属性:Al>Mg | |
| D. | 碱性:NaOH>Mg(OH)2>Al(OH)3,可说明钠、镁、铝金属性依次减弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 因为SO2有漂白性,所以它能使品红溶液、溴水褪色 | |
| B. | SO2和Cl2都有漂白作用,将两种气体同时作用于湿润的有色布条,漂白效果更好 | |
| C. | 在有些反应中显示氧化性,在有些反应中显示还原性 | |
| D. | 将SO2气体通入装有FeCl3溶液的试管里,黄色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com