
科目: 来源: 题型:选择题
| A. | 炒菜时放入食盐并不破坏NaCl中的化学键 | |
| B. | HCl的电子式是H+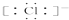 | |
| C. | HCl的结构式是H-Cl | |
| D. | NaCl熔化时破坏共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯水中加入石蕊试液,溶液只变红 | |
| B. | 配制一定物质的量浓度的溶液定容时仰视刻度会使得溶液浓度偏小 | |
| C. | 过氧化钠和HClO都可以使有色物质褪色且原理相同 | |
| D. | 向某溶液中滴加AgNO3溶液后,再加稀HNO3酸化,有黄色沉淀产生,证明含I- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{53}^{135}$I是碘的一种同素异形体 | |
| B. | ${\;}_{53}^{135}$I是一种新发现的元素 | |
| C. | 它的中子数是53 | |
| D. | 核内的中子数与核外电子数之差为29 |
查看答案和解析>>
科目: 来源: 题型:解答题
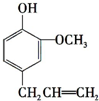 .丁子香酚的一种同分异构体对甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体.某校兴趣小组提出可以利用中学所学的简单有机物合成F,其方案如下,其中A的产量标志着一个国家石油化学工业的发展水平.
.丁子香酚的一种同分异构体对甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体.某校兴趣小组提出可以利用中学所学的简单有机物合成F,其方案如下,其中A的产量标志着一个国家石油化学工业的发展水平.
 .
.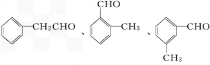 .
.查看答案和解析>>
科目: 来源: 题型:解答题
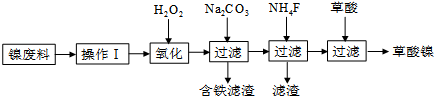
查看答案和解析>>
科目: 来源: 题型:解答题
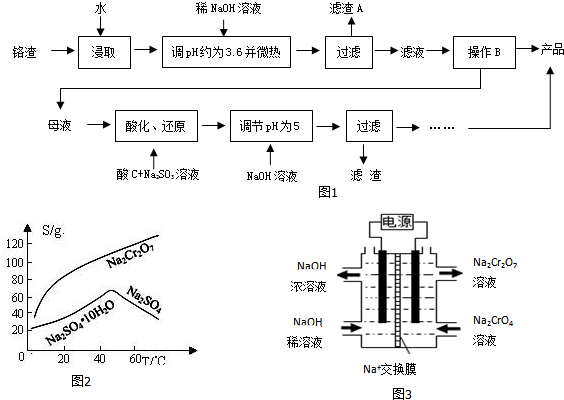
查看答案和解析>>
科目: 来源: 题型:选择题
| 成语 | 化学原理 | |
| A | 火树银花 | 发生了焰色反应 |
| B | 炉火纯青 | 通过观察火焰的颜色来判断炉内的温度 |
| C | 百炼成钢 | 通过多次锻炼,使生铁中碳等杂质因挥发而降低达到了钢的标准 |
| D | 青出于蓝而胜于蓝 | 蓝色的靛蓝染料发生化学反应生成一种深蓝色的新染料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
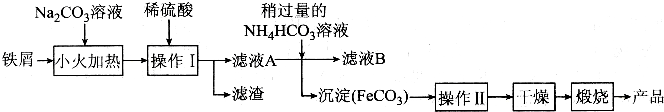
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷是烃类物质中氢的质量分数最高的化合物 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,分子数为NA的CO和C2H4混合气体的质量为28g | |
| B. | 标准状况下,20g重水(D2O)中含有的中子数为10NA | |
| C. | 用MnO2与浓盐酸制取Cl2时,每生成0.5mol Cl2则转移电子数为NA | |
| D. | 0.1 L 3.0 mol•L-1的NH4NO3溶液中含有NH4+的数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com