
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:3 | B. | 3:2 | C. | 1:4 | D. | 4:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 加入铁触媒做催化剂更有利于工业合成氨 | |
| D. | 锌粒粉碎后与稀硫酸反应产生氢气速度更快 |
查看答案和解析>>
科目: 来源: 题型:选择题
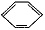 、④HCHO.下列说法正确的是( )
、④HCHO.下列说法正确的是( )| A. | 四种物质分子中,碳原子都是采取sp2杂化 | |
| B. | HCHO分子的空间构型为平面三角型,且分子中含有4个σ键 | |
| C. | 四种物质中所有原子都在同一平面内 | |
| D. | ①②两种有机物与H2发生加成反应时分子中的所有化学键发生断裂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3、H2、C2H6 | B. | H2O、CO2、H2SO4 | C. | SO2、SiO2、P2O5 | D. | CCl4、SiC、H2O2 |
查看答案和解析>>
科目: 来源: 题型:实验题
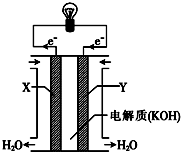 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:查看答案和解析>>
科目: 来源: 题型:填空题
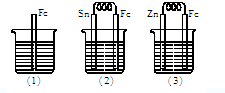
查看答案和解析>>
科目: 来源: 题型:实验题
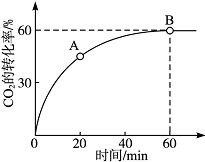 尿素[CO(NH2)2]是首个由无机物人工合成的有机物
尿素[CO(NH2)2]是首个由无机物人工合成的有机物查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com