
科目: 来源: 题型:多选题
| A. | 将实验完剩余的金属钠放回原试剂瓶中 | |
| B. | 测定熔融氢氧化钠的导电性,可在铁质坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 制备Fe(OH)3胶体通常是将饱和氯化铁溶液煮沸,直至呈红褐色时停止加热 | |
| D. | 在饱和NaOH溶液中加一定量Na2O2,充分反应后恢复到原温度,有晶体析出,溶液质量不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学键只存在于分子内,分子间作用力只存在于分子间 | |
| B. | 冰变为液态水时,共价键没有被破坏 | |
| C. | 液态氟化氢中存在氢键,所以其分子比氯化氢稳定 | |
| D. | 物质在溶于水的过程中,化学键一定会被破坏或改变 |
查看答案和解析>>
科目: 来源: 题型:填空题
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素. ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族. ,R、T的氢化物的稳定强的HCl(填化学式)
,R、T的氢化物的稳定强的HCl(填化学式)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢化物的稳定性甲>乙>丙 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:丙<甲 | |
| C. | 原子半径由大到小的顺序为:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验结论 | |
| A | SO2通入Ba(NO3)2溶液中 | 不产生沉淀 | 亚硫酸的酸性比硝酸弱 |
| B | 气体X通入酸性KMnO4中 | 溶液褪色 | 气体X有漂白性 |
| C | 取少量某无色溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分层,下层呈紫红色 | 原无色溶液中一定有I- |
| D | 将铜片放入稀硝酸中,加热 | 产生大量气体溶液变为蓝色 | 稀硝酸具有强氧化性和酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CaCO3(CaO) | B. | Na2O2(Na2O) | C. | Na2CO3(NaHCO3) | D. | MgO[Mg(OH)2] |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点下降 | |
| C. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| D. | 同主族元素随原子核电荷数的递增,原子半径依次增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
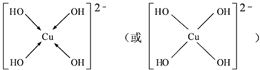 .
.查看答案和解析>>
科目: 来源: 题型:解答题
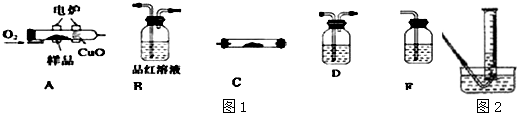
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 未充分加热 | B. | 加入葡萄糖太多 | ||
| C. | 加入NaOH溶液的量不够 | D. | 加入CuSO4溶液的量不够 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com