
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

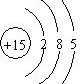 .
.查看答案和解析>>
科目: 来源: 题型:解答题
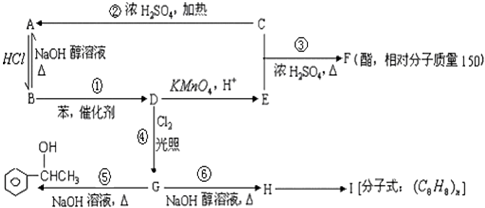

 ;③
;③ +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O;⑥
+H2O;⑥ .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
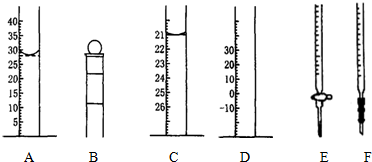
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 弱酸 | H2C2O4 | H2CO3 |
| 电离常数 | K1=5.4×10-2 K2=5.4×10-5 | K1=4.5×10-7 K2=4.7×10-11 |


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④③ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ①④③ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com