
科目: 来源: 题型:选择题
| A. | 定容时观察液面仰视 | B. | 定容时观察液面俯视 | ||
| C. | 有少量NaOH溶液残留在烧杯中 | D. | 容量瓶中原来有少量蒸馏水 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碘是人体必需微量元素,所以应多吃富含高碘酸的食物 | |
| B. | “血液透析”运用了胶体的性质 | |
| C. | 过氧化钠可作为高空飞行或潜水装置中的供氧剂 | |
| D. | 大力开发太阳能、风能、水能等新能源,减少煤、石油等化石燃料的使用,有利于实现“低碳经济” |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 维生素C能将食物中的Fe3+转化为易吸收的Fe2+,是因为维C有氧化性 | |
| B. | SO2、NO2等在大气中达到一定浓度造成大气污染.溶液的稳定性决定了污染的长期性 | |
| C. | 燃料电池能有效提高能源的利用率是因为通过原电池装置将热能直接转化成了电能 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行有效治理 |
查看答案和解析>>
科目: 来源: 题型:解答题
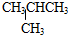
 和
和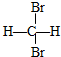
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com