
科目: 来源: 题型:选择题
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| C. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 氧化还原反应 | |
| B. | N2+3H2$?_{高温高压}^{催化剂}$2NH3可逆反应 | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl 置换反应 | |
| D. | CH2=CH2+Br2→CH2Br-CH2Br 加成反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
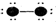
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只含非极性键的纯净物一定是单质 | B. | 只含极性键的纯净物一定是化合物 | ||
| C. | 离子化合物中一定有离子键 | D. | 纯净物中一定存在化学键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Fe2+、NO3- | B. | Na+、Mg2+、NO3- | C. | Cu2+、Ba2+、Cl- | D. | K+、Na+、HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 它的最外层电子数为4 | B. | 它的金属性比铅强 | ||
| C. | 它具有+2、+4价 | D. | 它的最高价氧化物的水化物是强酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两种分子的中心原子的杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中氮原子形成3个杂化轨道,CH4分子中碳原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 | |
| D. | 氨气分子是四原子化合物,甲烷为五原子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com