
科目: 来源: 题型:选择题
| A. | 将SO2通入含HClO的溶液中生成H2SO4,酸性:HClO>H2SO4 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和NaOH溶液及HF溶液反应,SiO2属于两性氧化物 | |
| D. | SO2使溴水褪色,SO2具有漂白性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 容量瓶中含有少量蒸馏水对所配制的溶液无影响 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 测定中和反应的中和热时,保温效果越好,测定误差越小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙醇完全燃烧生成水 | |
| B. | 0.1mol CH3CH2OH与足量金属钠反应生成0.05molH2 | |
| C. | 乙醇能与水以任意比例互溶 | |
| D. | 乙醇的沸点(78.5℃)比乙烷(-88.6℃)的高出许多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 | |
| D. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,振荡静置后,分液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子中的三个碳原子在同一直线上 | B. | 分子中所有原子都在同一平面上 | ||
| C. | 与HCl加成只生成一种产物 | D. | 能发生聚合反应,生成聚丙烯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 海水含镁,将金属钠放入海水中可以制取金属镁 | |
| B. | 从海水中提取溴的过程涉及氧化还原反应 | |
| C. | 利用海水制取精盐不涉及化学反应 | |
| D. | 海底多金属结核矿含有Fe、Mn、Co、B等金属 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题

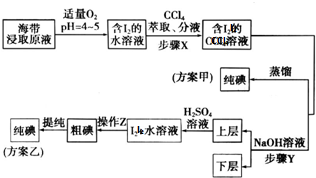
查看答案和解析>>
科目: 来源: 题型:选择题
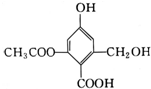
| A. | X的化学式为C10H10O6 | |
| B. | X在一定条件下能与FeCl3溶液发生显色反应 | |
| C. | X在一定条件下能发生消去反应和酯化反应 | |
| D. | 1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗的物质的量分别为3 mol、4 mol、1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com