
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:推断题
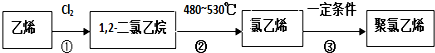
 ,反应类型为加聚反应;
,反应类型为加聚反应;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两者对应的氧化物均为碱性氧化物 | |
| B. | 两者的单质都不能与氢氧化钠溶液反应 | |
| C. | 常温条件下,两种金属都能溶解于浓硫酸中 | |
| D. | 制备AlCl3、FeCl3,均不能采用将其溶液直接蒸干的方法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 摩尔是一种国际基本物理量 | |
| B. | 标准状况下气体摩尔体积约为22.4 L | |
| C. | 氢的摩尔质量是2 g/mol | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目: 来源: 题型:实验题

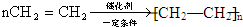 .
.查看答案和解析>>
科目: 来源: 题型:实验题
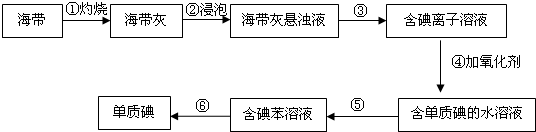
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素符号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 离子半径大小:r(X2+)>r(Q2-) | |
| B. | Y与Q形成的化合物不能跟氢氧化钠溶液反应 | |
| C. | M元素与L元素形成的一种化合物是常见的有机溶剂 | |
| D. | Z的单质可在氧气中燃烧生成ZO3 |
查看答案和解析>>
科目: 来源: 题型:推断题
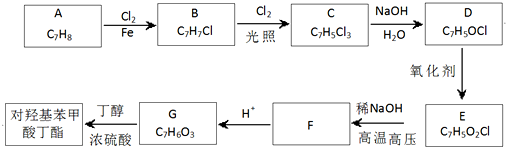
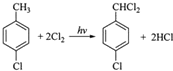 ;
; ;
; ;
;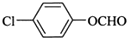 (写结构简式).
(写结构简式).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解熔融NaCl制取Na,故电解熔融MgCl2也能制取Mg | |
| B. | Fe与CuSO4溶液反应置换出Cu,故Na也能从CuSO4溶液中置换出Cu | |
| C. | 铝和硫加热得到Al2S3,故铁和硫加热得到Fe2S3 | |
| D. | CO2和Na2O2反应生成Na2CO3和O2,故SO2和Na2O2反应生成Na2SO3和O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com