
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
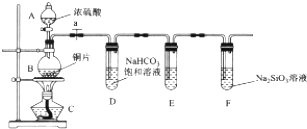
查看答案和解析>>
科目: 来源: 题型:解答题
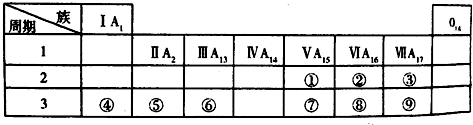
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率0.8 mol/(L•s)是指1 s时某物质的浓度为0.8 mol/L | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
查看答案和解析>>
科目: 来源: 题型:推断题
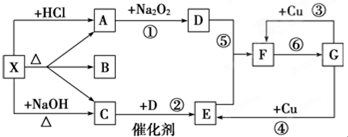
查看答案和解析>>
科目: 来源: 题型:解答题
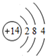 ,D在元素周期表中的位置第3周期第VIA族
,D在元素周期表中的位置第3周期第VIA族 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+、Ba2+、HCO3-、Cl- | B. | K+、SO42-、S2-、Cl- | ||
| C. | NH4+、AlO2-、Cl-、OH- | D. | K+、Fe3+、I-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅胶可作袋装食品的干燥剂 | |
| B. | 用活性炭可除去冰箱中的异味 | |
| C. | CO2、NO2、或SO2都会导致酸雨的形成 | |
| D. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com