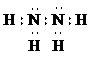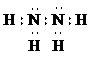氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用.完成下列问题:
(1)在一密闭容器中,进行如下化学反应:N
2(g)+3H
2(g)?2NH
3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
| T |
298K |
398K |
498K |
… |
| K |
4.1×106 |
K1 |
K2 |
… |
①比较K
1、K
2的大小:K
1>
>
K
2(填“>”、“=”或“<”).
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是
acd
acd
(填序号).
a.2v
正(H
2)=3v
逆(NH
3) b.v
正(N
2)=3v
逆(H
2)
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的体积不变,达到平衡状态后再向容器中通入一定量的N
2,此时逆反应速率
不变
不变
(填“增大”、“减小”或“不变”);平衡向
正反应
正反应
方向移动.
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则K
sp(AgCl)
>
>
K
sp(AgBr).
(2)肼是氮元素的另一种氢化物,分子式为N
2H
4.
①写出肼的电子式
,它属于
极
极
性分子.
②298K时,1.00g N
2H
4(l)与足量的N
2O
4(l)完全反应生成氮气和水,放出19.15kJ的热量.写该反应的热化学方程式
2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6 kJ/mol
2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6 kJ/mol
.
③肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H
+的固体电解质,请写出负极反应式
N2H4-4e-═N2+4H+
N2H4-4e-═N2+4H+
.


 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: