
科目: 来源: 题型:推断题
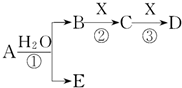 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):查看答案和解析>>
科目: 来源: 题型:选择题
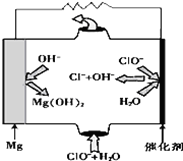 镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 该电池的总反应为:Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| C. | 电池工作时,正极周围溶液的碱性将不断减弱 | |
| D. | 电池工作时,OH-向正极移动 |
查看答案和解析>>
科目: 来源: 题型:推断题
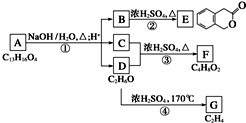 图中A、B、C、D、E、F、G均为有机化合物.根据下图回答问题.
图中A、B、C、D、E、F、G均为有机化合物.根据下图回答问题. .反应①的反应类型是水解反应(取代反应).
.反应①的反应类型是水解反应(取代反应).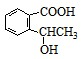 、
、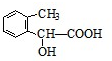 、
、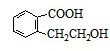 .
.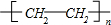 或CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.
或CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.查看答案和解析>>
科目: 来源: 题型:实验题
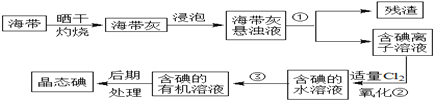
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过量CO2通入NaOH溶液中:CO2+2OH-═CO32-+H2O | |
| B. | 铜与足量浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| C. | 碳酸钠固体溶于水:CO32-+2H2O?H2CO3+2OH- | |
| D. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠块在乙醇的液面上游动 | B. | 钠块熔化成小球 | ||
| C. | 钠块沉在乙醇液面的下面 | D. | 钠块表面没有气体放出 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
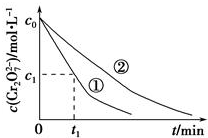 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水 体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (1)(2)(5)(6) | B. | (1)(4)(5) | C. | (2)(4)(6) | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com