
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
| B | 滴入KI试液 | 检验淀粉是否已完全水解 |
| C | 先滴入Ba(NO3)2溶液.产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
| D | 向乙醇溶液加入钠粒 | 测定乙醇分子中含有羟基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用洁净铂丝蘸取未知溶液进行焰色反应,呈黄色火焰,则该溶液有Na+,但不能确定K+的存在 | |
| B. | 实验室制取乙酸乙酯时,向试管中加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸 | |
| C. | 用已知浓度NaOH溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,则测得盐酸浓度偏小 | |
| D. | 相同温度下,可以通过观察气泡多少来比较不同浓度Na2SO3溶液与稀H2SO4溶液反应的快慢 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D |
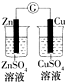 | 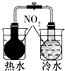 | 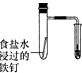 | 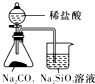 |
| 验证化学能转化为电能 | 验证温度对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证非金属Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:推断题
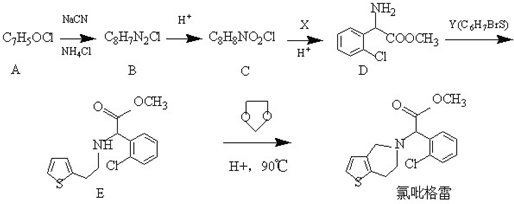
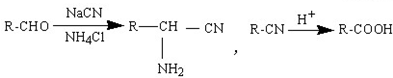
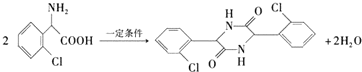 .
.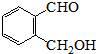 为有机原料制备化合物的合成路线流程图
为有机原料制备化合物的合成路线流程图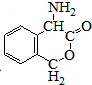 (无机试剂任选).合成路线流程图示例如下:
(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
科目: 来源: 题型:推断题
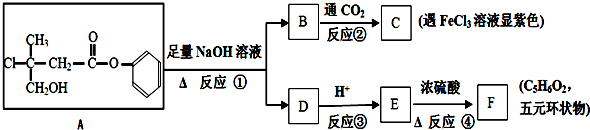
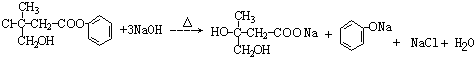 .
.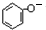 +CO2+H2O→
+CO2+H2O→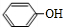 +HCO3-.
+HCO3-. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g)△H<0其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大 | |
| B. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| C. | 合成氨反应是放热反应,所以工业合成氨时温度越低越好 | |
| D. | 恒温、恒容的条件下对于N2(g)+3H2(g)?2NH3(g)△H<0的反应,混合气体的平均相对分子质量不变可以作为其达到化学平衡状态的标志 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.02NA | |
| B. | 标准状况下,11.2 L乙醇所含的羟基数为0.5NA | |
| C. | 1 mol Fe与1 mol Cl2反应转移电子数一定为3NA | |
| D. | 常温常压下,19g H3O+含有10NA个电子 |
查看答案和解析>>
科目: 来源: 题型:推断题
 ,A的结构简式CH2=CH2.
,A的结构简式CH2=CH2. ,反应类型取代反应.
,反应类型取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com