
科目: 来源: 题型:选择题
| A. | N2H4是氧化产物 | |
| B. | 配平后,OH-的化学计量数是2 | |
| C. | 生成3.2g N2H4 转移0.1mol 电子 | |
| D. | 氧化剂与还原剂物质的量之比为1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5mol/L | B. | 3mol/L | C. | 2mol/L | D. | 7mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
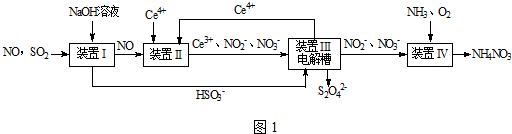
查看答案和解析>>
科目: 来源: 题型:解答题
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如右图 |  |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁强化酱油可通过膳食补充人体所需的铁元素 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | 宇航服主要成分是由碳化硅陶瓷和碳纤维复合而成,是一种新型无机非金属材料 | |
| D. | 淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:解答题
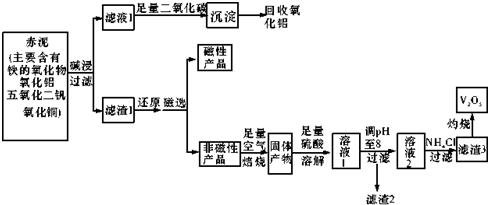
| 物质 | V205 | NH4V03 | (V02)2S04 |
| 溶解性 | 难溶 | 难溶 | 易溶 |
| Cu2+ | Fe2+ | Fe3+ | |
| 开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
| 完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将AlCl3溶液与Na2S溶液混合 | B. | 将H2S气体通入Al2(SO4)3溶液中 | ||
| C. | 将Al(NO3)3固体与K2S固体混合 | D. | 将金属铝与硫混合加热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子半径:E<D | |
| B. | 气态氢化物的稳定性:B<E | |
| C. | 最高价氧化物对应水化物的碱性:C>D | |
| D. | A与E形成的化合物为离子化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
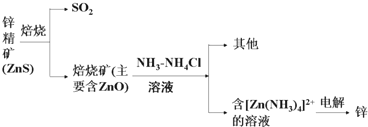
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com