
科目: 来源: 题型:实验题
| 实验编号 | 实验操作 | 实验现象 |
| a | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol•L-1 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中无明显气泡产生 试管B中出现大量气泡 |
| b | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 两支试管中都未见明显气泡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| B. | 淀粉和纤维素都可以作为工业上生产葡萄糖的原料 | |
| C. | 葡萄糖、油脂、蛋白质在一定条件下均可以发生水解反应 | |
| D. | 蔗糖、果糖的分子式均为C6H12O6,二者互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:实验题
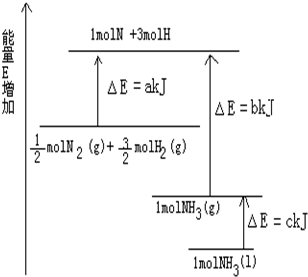 已知化学反应N2+3H2═2NH3的能量变化如图所示,
已知化学反应N2+3H2═2NH3的能量变化如图所示,查看答案和解析>>
科目: 来源: 题型:实验题
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 探究不同温度对反应速率的影响 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影 响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目: 来源: 题型:实验题
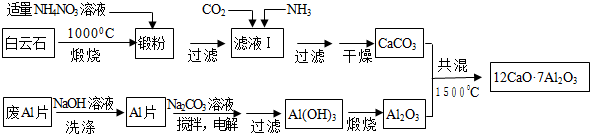
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com