
科目: 来源: 题型:选择题
| A. | 铸铁输油管道应埋在干燥致密不透气的土壤中 | |
| B. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| C. | 钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-=4OH- | |
| D. | 在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
查看答案和解析>>
科目: 来源: 题型:选择题
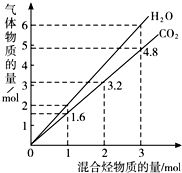 两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )| A. | ②⑤⑥ | B. | ②⑥ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 1:4 | D. | 3:2 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:推断题
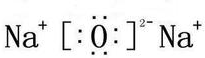 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 核内有8个中子的碳原子:$\stackrel{8}{6}$ C | B. | 氯离子的结构示意图: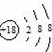 | ||
| C. | HCl的电子式: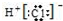 | D. | 甲烷分子的比例模型: |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食盐 | |
| B. | 料酒中的乙醇和食醋中的乙酸反应生成的乙酸乙酯 | |
| C. | 料酒中的乙醇 | |
| D. | 食醋中的乙酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过渡元素形成的化合物 | B. | 第ⅢA族元素形成的化合物 | ||
| C. | 第ⅣA族元素形成的化合物 | D. | 第ⅦA族元素形成的化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 48 | B. | 80 | C. | 128 | D. | 208 |
查看答案和解析>>
科目: 来源: 题型:解答题
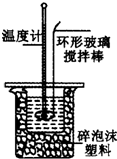 某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com