
科目: 来源: 题型:实验题
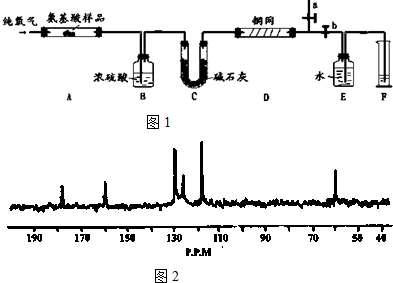
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
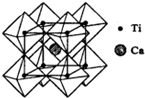 钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:
钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下: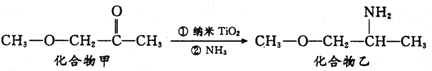
查看答案和解析>>
科目: 来源: 题型:填空题
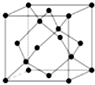 A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题:
A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题: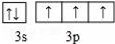 .
.查看答案和解析>>
科目: 来源: 题型:实验题
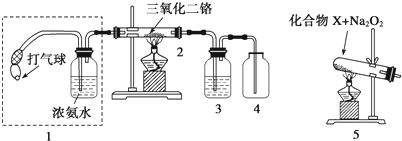
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③⑤ | B. | ③④ | C. | ①③ | D. | ①⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验目的 | 实验内容 | |
| A | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中,再加水稀释 |
| B | 探究温度对硫代硫酸钠与硫酸反应速率的影响 | 先将两种溶液混合并计时,再用水浴加热至设定温度 |
| C | 证明Ksp(BaSO4)<Ksp(CaSO4) | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. |
| D | HSO3-结合H+的能力比SO32-强 | 室温下,用pH试纸测得:0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向水中加入少量硫酸氢钠溶液,c(H+)增大,KW不变 | |
| B. | 降低温度,KW减小,pH不变 | |
| C. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量NaClO固体,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 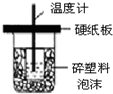 如图装置用于中和热的测定 | |
| B. | 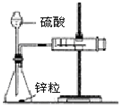 如图装置用于测定氢气的反应速率(单位mL/s) | |
| C. | 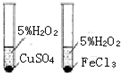 如图装置用于研究催化剂Cu2+和Fe3+对反应速率的影响 | |
| D. | 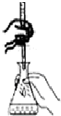 如图装置用于已知浓度的高锰酸钾溶液测定未知浓度的草酸溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com