
科目: 来源: 题型:推断题
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.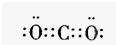 .
.查看答案和解析>>
科目: 来源: 题型:实验题
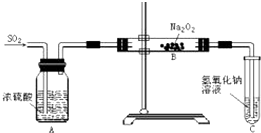 有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.
有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.6 mol•L-1 | B. | 0.8 mol•L-1 | C. | 1.0 mol•L-1 | D. | 1.2 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
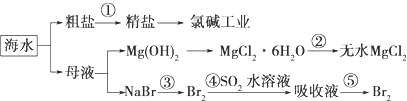
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液-→过滤后加盐酸 | |
| B. | 从第③步到第⑤步的目的是浓缩、富集溴 | |
| C. | 第①到第⑤步中,涉及到氧化还原反应共有2步 | |
| D. | 第④步中,SO2起氧化作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入氢气的电极为原电池的正极 | |
| B. | 两极材料都用石墨,用稀盐酸做电解质溶液 | |
| C. | 电解质溶液中的阳离子向通氯气的电极移动 | |
| D. | 通氯气的电极反应式为Cl2+2e-═2Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 在过氧化钠中加入稀硫酸:O22-+4H+═2H2O+O2↑ | |
| C. | 澄清石灰水与过量的小苏打溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铱为非金属元素 | |
| B. | ${\;}_{77}^{192}$Ir中子数与质子数的差为38 | |
| C. | 铱元素与碘元素位于同一周期 | |
| D. | ${\;}_{77}^{192}$Ir核外含有115个电子 |
查看答案和解析>>
科目: 来源: 题型:推断题
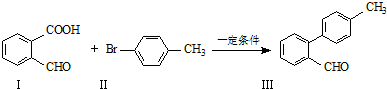
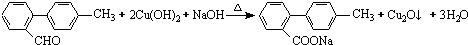 .
.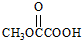 与
与  也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为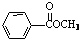 .
.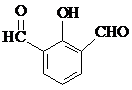 、
、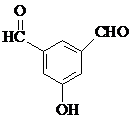 、
、 (要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com