
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,5.6 LCCl4含有的分子数为0.25NA | |
| B. | 常温常压下,8g CH4含有的分子数为0.5NA | |
| C. | 7.8g Na2O2与足量水反应,转移电子数为0.2NA | |
| D. | 常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA |
查看答案和解析>>
科目: 来源: 题型:实验题
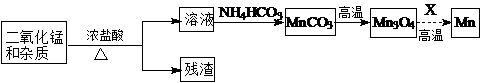
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷可用作燃料,说明甲烷燃烧是释放能量的反应 | |
| B. | 生成物总能量一定低于反应物总能量 | |
| C. | 干冰气化需要吸收大量的热,这个变化是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| Q | X | Y | ||
| M | W | Z |
| A. | 相同条件下,Q元素最低价简单氢化物是同主族元素中氢化物沸点最高的 | |
| B. | 物质W3X4中,每个原子最外层均达到8电子稳定结构 | |
| C. | X、Q、Y和氢形成的化合物中可能既有离子键、又有共价键 | |
| D. | 将Q的最高价氧化物分别通入W的盐溶液和M的盐溶液中均可产生白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (5a+2b) kJ | B. | (4b-10a) kJ | C. | (5a-2b) kJ | D. | (10a+4b) kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24LH2O含有的分子数等于0.1NA | |
| B. | 0.5mol/L 的AlCl3溶液中含有的Al3+数为0.5 NA | |
| C. | 常温常压下16g O2中,氧原子数为NA | |
| D. | 1mol过氧化钠与水充分反应,转移的电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汤姆生 | B. | 道尔顿 | C. | 拉瓦锡 | D. | 门捷列夫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com