
科目: 来源: 题型:选择题
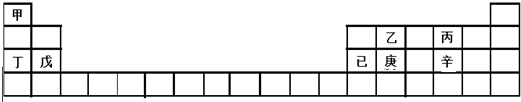
| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
查看答案和解析>>
科目: 来源: 题型:实验题
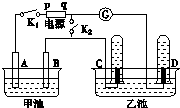 在如图所示均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:
在如图所示均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| B. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| C. | 以淀粉为原料可制取乙酸乙酯 | |
| D. | 食用花生油和鸡蛋清都能发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
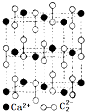 从结构的角度可以帮助我们更好的理解有机物的化学性质.
从结构的角度可以帮助我们更好的理解有机物的化学性质.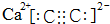 ,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3
,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3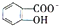 判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是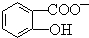 中-OH的氢原子形成分子内氢键,使其更难电离出H+.
中-OH的氢原子形成分子内氢键,使其更难电离出H+.查看答案和解析>>
科目: 来源: 题型:实验题
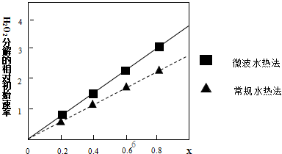
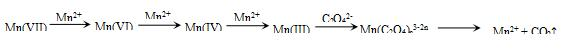
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | \ | 18 |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | 阴离子还原性:W>Q | |
| B. | X的最低价氢化物能形成分子间氢键 | |
| C. | Z能在自然界中以游离态存在 | |
| D. | Na与Y能形成化合物Na2Y2,1 mol Na2Y2与CO2反应,转移电子数为1 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属Na熔沸点高于金属K | |
| B. | 非金属性N>P,但是单质活泼性:氮气<白磷 | |
| C. | 相同条件下,NH3在水中的溶解度大于PH3 | |
| D. | SiC晶体的熔点比晶体硅的高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com