
科目: 来源: 题型:选择题
| A. | 全部 | B. | 除④⑥⑦以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
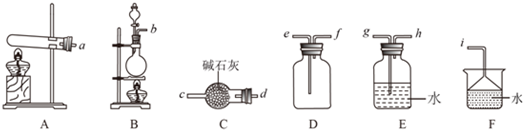
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向稀醋酸中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 (1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);
(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
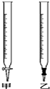 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程.请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程.请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④⑤ | B. | ③④⑤ | C. | ③⑤ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
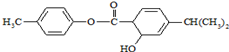
| A. | M中不含手性碳原子 | |
| B. | M中所有碳原子均可能在同一平面 | |
| C. | M可以发生加成、取代、消去等反应 | |
| D. | 1mol M常温下最多可以与3molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com