
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:实验题
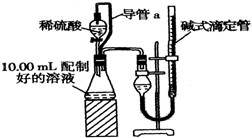
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 常温常压下,26g苯乙烯和苯组成的混合物中所含有的碳原子数为4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (c-a-b)kJ | B. | (a+b-c)kJ | C. | (2c-a-b)kJ | D. | (2c-a-b)/2 kJ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
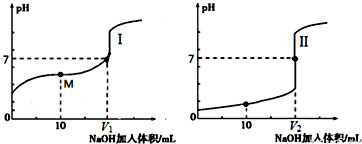
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 | 出现黄色沉淀 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 | |
| B. | 减少化石燃料使用,有利于降低空气中PM2.5的值 | |
| C. | 淀粉、豆油、蛋白质都是天然高分子化合物 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 对废气、废水、废渣进行严格处理 | |
| B. | 在化工生产中少用或不用有害物质以及少排放或不排放有害物质 | |
| C. | 在化工生产中,不使用任何化学物质 | |
| D. | 在化工厂种草种树,使其成为花园式工厂 |
查看答案和解析>>
科目: 来源: 题型:选择题
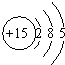
| A. | 磷元素位于元素周期表的第三周期第ⅤA族 | |
| B. | 磷元素是非金属元素 | |
| C. | 磷原子比氮原子和硫原子的得电子能力强 | |
| D. | 磷的最高价氧化物的水化物可以写成H3PO4或HPO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com