
科目: 来源: 题型:实验题
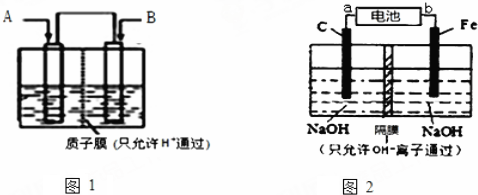
查看答案和解析>>
科目: 来源: 题型:填空题
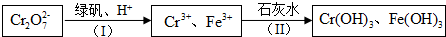
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
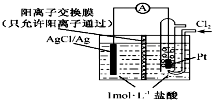 某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )
某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )| A. | 正极反应为AgCl+e-=Ag+Cl- | |
| B. | 电池工作时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用KCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.2 mol e-时,交换膜左侧溶液中约减少0.4 mol离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y和W的含氧酸均为强酸 | |
| B. | YW3分子中Y原子的杂化方式为sp2,分子的空间构型为平面三角形 | |
| C. | 由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 | |
| D. | 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
查看答案和解析>>
科目: 来源: 题型:选择题
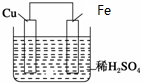 如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )| A. | ①②③ | B. | ③④ | C. | ③④⑤ | D. | ③④⑥ |
查看答案和解析>>
科目: 来源: 题型:推断题
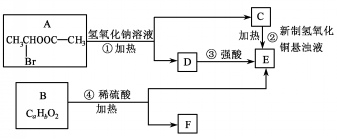
 .
.查看答案和解析>>
科目: 来源: 题型:推断题
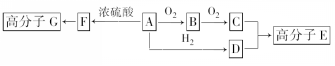
 .
. +2H2O.
+2H2O.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
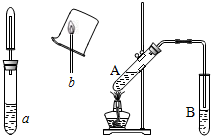 乙醇性质探究
乙醇性质探究查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com