
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
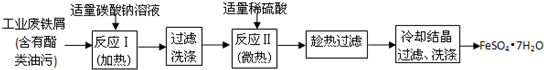
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目: 来源: 题型:
| 元素编号 | A | B | C | D | E |
| X | 3.5 | 3.0 | X3 | 1.5 | 1.5 |
| 主要化合价 | -2 | +7 | +6 | +3 | +2 |


查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示.则:
向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示.则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com