
科目: 来源: 题型:选择题
| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
查看答案和解析>>
科目: 来源: 题型:解答题
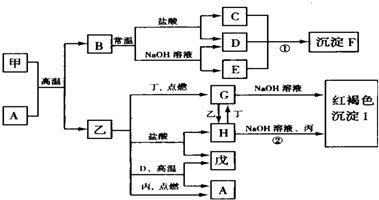 已知在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物.
已知在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物. ;
;查看答案和解析>>
科目: 来源: 题型:实验题
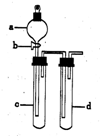 某兴趣小组设计出如图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方 案 | 反 应 物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
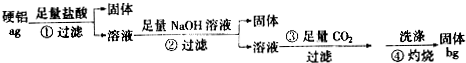
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20Ne和22Ne互为同位素 | B. | 20Ne和22Ne的质子数为10 | ||
| C. | 20Ne和22Ne的电子数相同 | D. | 20Ne和22Ne的中子数相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
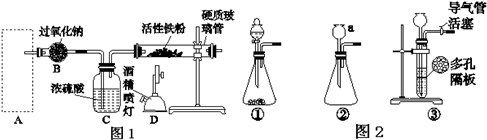
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 油脂在碱性条件下发生皂化反应 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖、蔗糖、麦芽糖都能发生银镜反应 | |
| D. | 蛋白质水解的最终产物都是氨基酸 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:H2S>PH3>SiH4>HCl | D. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 中和滴定达中点时俯视滴定管内液面度数 | |
| B. | 碱式滴定管用蒸馏水洗净后立即装待测溶液来滴定 | |
| C. | 酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 | |
| D. | 把配好的标准溶液倒入刚用蒸馏水洗净的锥形瓶中然后用来滴定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com