
科目: 来源: 题型:选择题
| A. | 福尔马林 | B. | 18.4 mol•L-1的硫酸溶液 | ||
| C. | 饱和Na2SO4溶液 | D. | 1 mol•L-1的CuSO4溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题
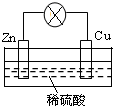
查看答案和解析>>
科目: 来源: 题型:选择题
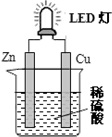
| A. | 锌片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 如果将硫酸换成柠檬汁,导线中就不会有电子流动 | |
| D. | 如果将铜片换成锌片,LED灯仍然会发光 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4LCH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,16g14CH4所含中子数数目为8NA | |
| C. | 15.6gNa2O2和水完全反应转移的电子数为0.2NA | |
| D. | 0.1L3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲醛浸泡的海产品 | |
| B. | 霉变的大米、花生 | |
| C. | 用亚硝酸钠(NaNO2)代替食盐烹调的食品 | |
| D. | 食盐腌制的咸鸭蛋 |
查看答案和解析>>
科目: 来源: 题型:多选题
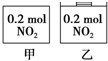 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲 | |
| B. | 平衡时N2O4的百分含量:乙>甲 | |
| C. | 平衡时甲中的压强与乙中的压强:甲>乙 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯分子的结构简式可能为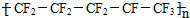 | |
| D. | 四氟乙烯中所有原子均在同一平面内 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:实验题
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com