
科目: 来源: 题型:选择题
| A. | 化合反应 | B. | 复分解反应 | C. | 分解反应 | D. | 取代反应 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VIIA族元素氢化物沸点顺序也是:HBr>HCl>HF | |
| B. | CH4是正四面体结构,则SiH4也是正四面体结构 | |
| C. | 锂与氧气反应:4Li+O2$\frac{\underline{\;加热\;}}{\;}$2 Li2O,则钠与氧气反应:4Na+O2$\frac{\underline{\;加热\;}}{\;}$2Na2O | |
| D. | CaCO3与稀硝酸反应生成CO2,则CaSO3与稀硝酸反应生成SO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铍的最高价氧化物的水化物可能具有两性 | |
| B. | 砹单质是有色固体,砹化氢很不稳定 | |
| C. | 碳酸锶难溶于水,但易溶于盐酸 | |
| D. | 砷的最高价氧化物的水化物是一种强酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③ | B. | ②④⑦ | C. | ③⑥ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:推断题
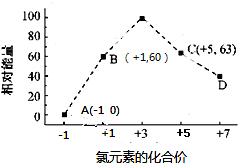
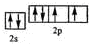 ,该元素的名称是氧;
,该元素的名称是氧;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 磺化、硝化、水化、风化、钝化等都是化学变化 | |
| B. | 干馏、常压分馏、减压分馏都是物理变化 | |
| C. | 甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰 | |
| D. | 水煤气、裂解气、焦炉气、天然气都是混合物 |
查看答案和解析>>
科目: 来源: 题型:实验题
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.查看答案和解析>>
科目: 来源: 题型:选择题
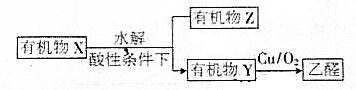
| A. | X可能是淀粉或纤维素 | B. | Y与CH3OCH3互为同分异构体 | ||
| C. | Z可能含有多个羧基 | D. | X中含有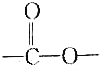 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com