
科目: 来源: 题型:选择题
| O═O(g) | H-H(g) | H-O(g) | |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | X | 463 |
| A. | 920 | B. | 557 | C. | 436 | D. | 188 |
查看答案和解析>>
科目: 来源: 题型:选择题
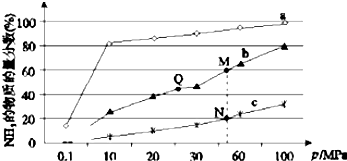
| A. | 上图中M、N、Q点平衡常数K 的大小关系为K(M)=K(Q)>K(N) | |
| B. | 加催化剂能加快反应速率但H2的平衡转化率不变 | |
| C. | 相同压强条件下,投料相同,达到平衡所需时间关系为a>b>c | |
| D. | 由曲线a可知,当压强增加到10OMPa以上,NH3的物质的量分数可达到100% |
查看答案和解析>>
科目: 来源: 题型:填空题
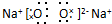 ,甲中的化学键类型为离子键、共价键.
,甲中的化学键类型为离子键、共价键.查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | b | A |
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | D |
| 乙酸乙酯(乙酸) | d | A |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目: 来源: 题型:推断题

 .
.查看答案和解析>>
科目: 来源: 题型:填空题
 ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:| 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218.4 | 113 | 271 | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目: 来源: 题型:推断题
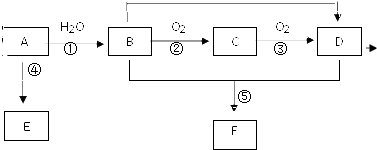 已知 A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成高分子化合物 E 和一种具有果香味的物质 F,其合成路线如图所示.
已知 A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成高分子化合物 E 和一种具有果香味的物质 F,其合成路线如图所示.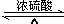 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com