
科目: 来源: 题型:选择题
 一定温度下,密闭容器内某一反应中X、Y的物质的量随反应时间变化的曲线如图所示,下列叙述中不正确的是( )
一定温度下,密闭容器内某一反应中X、Y的物质的量随反应时间变化的曲线如图所示,下列叙述中不正确的是( )| A. | 反应的化学方程式为:2X?Y | B. | t1时,Y的浓度是X浓度的2倍 | ||
| C. | t2时,正反应速率大于逆反应速率 | D. | t3时,正逆反应速率相等,达到平衡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3和H2O化学反应速率关系是2v正(NH3)=3v正(H2O) | |
| B. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
查看答案和解析>>
科目: 来源: 题型:推断题

 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$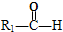 +
+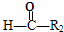 ,
,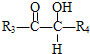 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$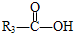 +
+
 .
. .
.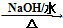 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 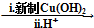 HCOOH
HCOOH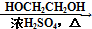 HCOOCH2CH2OOCH(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
HCOOCH2CH2OOCH(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 | |
| B. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 | |
| C. | 在同一能级上运动的电子,其运动状态可能相同 | |
| D. | 若ABn的中心原子A上没有未用于形成共价键的孤对电子,当n=3,则分子结构为三角锥形 |
查看答案和解析>>
科目: 来源: 题型:选择题
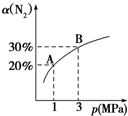 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 平衡状态由A变到B时,平衡常数K(A)=K(B) | |
| B. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| C. | 升高温度,逆反应速率增大,正反应速率减小 | |
| D. | 上述反应达到平衡后,增大H2浓度,平衡正向移动,H2转化率增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
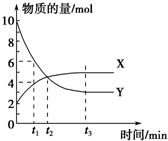 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | B. | t1时,Y的浓度是X浓度的2倍 | ||
| C. | t2时,正、逆反应速率相等 | D. | t3时,正、逆反应速率相等 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com