
科目: 来源: 题型:填空题
| 装置 | 操作 | 现象 |
 | 添加试剂,检查装置气密性,点燃酒精灯 | i.C中气体颜色变浅 ii.稍后,C中出现白烟并逐渐增多 |

 .
.
查看答案和解析>>
科目: 来源: 题型:实验题
 +NaOH→
+NaOH→ +
+
 +HCl→
+HCl→

 .
.查看答案和解析>>
科目: 来源: 题型:实验题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
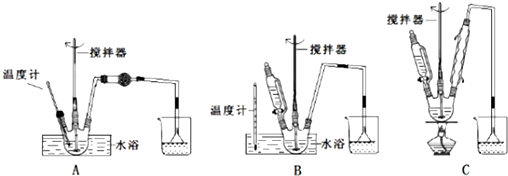
查看答案和解析>>
科目: 来源: 题型:选择题
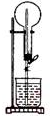 如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体.挤压滴管的胶头,下列与实验事实不相符的是( )
如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体.挤压滴管的胶头,下列与实验事实不相符的是( )| A. | CO2(NaOH溶液)/无色喷泉 | B. | NH3(H2O含石蕊)/红色喷泉 | ||
| C. | H2S(CuSO4溶液)/黑色喷泉 | D. | HCl(AgNO3溶液)/白色喷泉 |
查看答案和解析>>
科目: 来源: 题型:实验题
 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 112.8 | -78 | -77 |
| 沸点/℃ | 444.6 | 59.6 | 137 |

查看答案和解析>>
科目: 来源: 题型:解答题
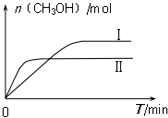 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目: 来源: 题型:推断题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题
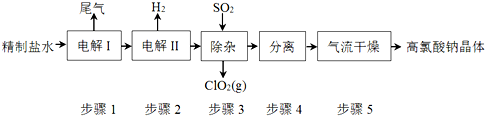
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com