
科目: 来源: 题型:选择题
| A. | 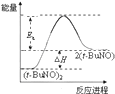 | B. | 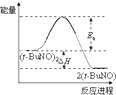 | C. | 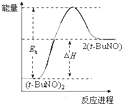 | D. | 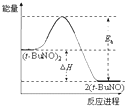 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:计算题
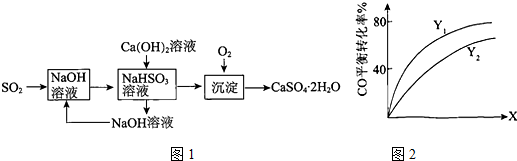
 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.查看答案和解析>>
科目: 来源: 题型:选择题
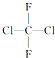 下列有关叙述正确的是( )
下列有关叙述正确的是( )| A. | 它有两种同分异构体 | B. | 它是平面分子 | ||
| C. | 它只有一种结构 | D. | 它有4种同分异构体 |
查看答案和解析>>
科目: 来源: 题型:实验题
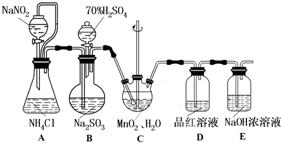
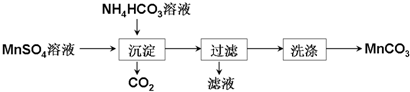
查看答案和解析>>
科目: 来源: 题型:推断题
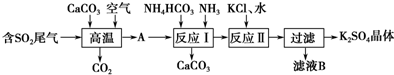
查看答案和解析>>
科目: 来源: 题型:推断题
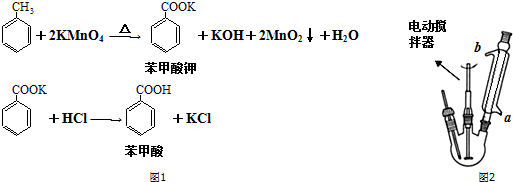
| 化合物 | 相对分子质量 | 密度(g•cm-3) | 溶解性 | 沸点(℃) |
甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | - | 易溶于水 | - |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
查看答案和解析>>
科目: 来源: 题型:实验题
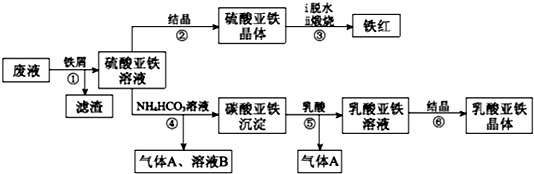
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com