
科目: 来源: 题型:解答题
| 指示剂 | 变色范围 | 酸色 | 碱色 |
| 石蕊 | 5.0-8.0 | 红色 | 蓝色 |
| 酚酞 | 8.0-10.0 | 无色 | 红色 |
| 甲基橙 | 3.1-4.4 | 红色 | 黄色 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加水稀释 | B. | 加少量NaOH溶液 | C. | 改用98%的浓硫酸 | D. | 锌片改为锌粒 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 铝离子的结构示意图: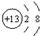 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 将废弃的秸秆转化为清洁高效的能源 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 采用新技术开采煤、石油和天然气,以满足经济发展的需要 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
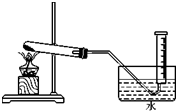 为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ•mol-1,冰中氢键键能为20 kJ•mol-1,假设1 mol 冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,电离常数K$\frac{(ca)^{2}}{c(1-a)}$=.若加水稀释,则CH3COOH?CH3C00-+H+向右移动,a增大,Ka不变 | |
| C. | 甲烷的标准燃烧热为-890.3 kjJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH3 (g)+202(g)-C02(g)+2H20(1)△H=-890.3 kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:推断题
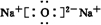 、
、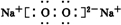 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com