
科目: 来源: 题型:实验题
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡,再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2的电子式: | B. | 8个中子的碳原子的符号:12C | ||
| C. | 次氯酸分子的结构式:H-O-Cl | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目: 来源: 题型:实验题
 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下: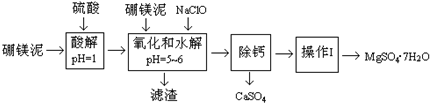
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Mg2+、NO3-、K+、Cl- | B. | Fe2+、NO3-、Al3+、Cl- | ||
| C. | Mg2+、SO42-、Na+、HCO3- | D. | K+、NH4+、AlO2-、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
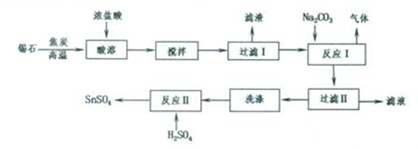
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4,NH3,H2O,Ne | B. | OH-,NH4+,H3O+,Ne | ||
| C. | H3O+,NH4+,Na+,HF | D. | OH-,F-,Mg2+,Na+ |
查看答案和解析>>
科目: 来源: 题型:选择题
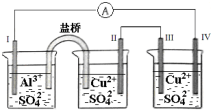
| A. | 电流方向:电极IV→电极I | |
| B. | 盐桥中的阳离子流向装 Al2(SO4)3池 | |
| C. | 电极 II 逐渐溶解 | |
| D. | 电极 III 的电极反应:Cu2++2e-=Cu |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
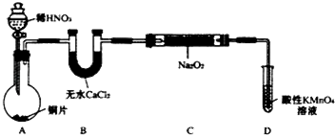
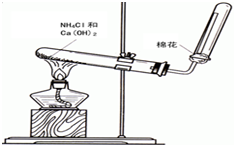 氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com