
科目: 来源: 题型:选择题
| A. | 石油的分馏可得到汽油 | |
| B. | 石油分馏得到的重油经过催化裂化可以得到汽油 | |
| C. | 汽油是烃的混合物,煤油、柴油是由烃构成的纯净物 | |
| D. | 石油裂解是为了获得更多化工原料,如乙烯、丙烯等 |
查看答案和解析>>
科目: 来源: 题型:实验题
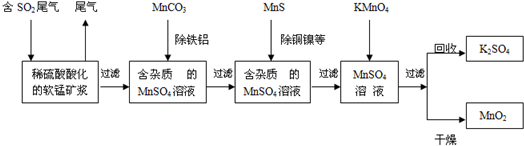
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 实验②中,混合物过量 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g的混合物全部反应 |
查看答案和解析>>
科目: 来源: 题型:推断题
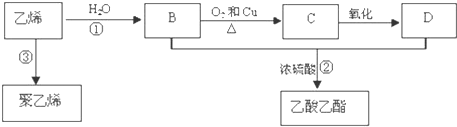
 CH3COOC2H5+H2O;③
CH3COOC2H5+H2O;③ .
.
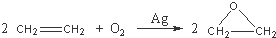
查看答案和解析>>
科目: 来源: 题型:推断题
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学变化一定伴随能量变化 | |
| B. | 化学变化一定有化学键的断裂和生成 | |
| C. | 化学变化一定放热 | |
| D. | 化学变化一定有新物质生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HClO2 | B. | H2SeO3 | C. | H3BO3 | D. | HMnO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油的分馏是物理变化,得到的各个馏分都是纯净物 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | CH3CH218OH和CH3COOH反应生成的水的相对分子质量为18 | |
| D. | 石油裂解可以得到乙烯,煤干馏得到的煤焦油中可以提取苯,乙烯和苯使溴水褪色的原理相同 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com