
科目: 来源: 题型:选择题
| A. | 向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32-和AlO${\;}_{2}^{-}$ | |
| C. | 用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+ | |
| D. | 取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH${\;}_{4}^{+}$、Al3+、Cu2+ |
查看答案和解析>>
科目: 来源: 题型:实验题
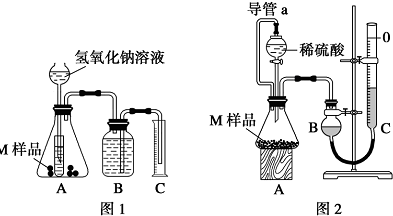
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 至少存在5 种离子 | |
| B. | SO42-、NH4+、Fe3+、一定存在,Cl-、K+、Al3+可能存在 | |
| C. | K+一定存在,Al3+可能存在 | |
| D. | Cl-一定存在,且c(Cl-)≥0.4mol/L |
查看答案和解析>>
科目: 来源: 题型:推断题
| J | ||||
| R | T |
 .
.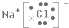 .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 主族元素原子的最外层电子数越多,元素的金属性越强 | |
| B. | C、N、0、F元素的单质与氢气化合越来越剧烈 | |
| C. | 图是元素周期表中碘元素的部分信息,可知该碘原子的质量数为126.9 | |
| D. | 元素在周期表中的族序数与该元素原子电子层数相等 |
查看答案和解析>>
科目: 来源: 题型:实验题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
查看答案和解析>>
科目: 来源: 题型:填空题
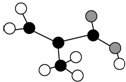 (1)经分析,某芳香族化合物A含C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物一个分子中只含有一个氧原子.
(1)经分析,某芳香族化合物A含C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物一个分子中只含有一个氧原子.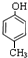 ;
;查看答案和解析>>
科目: 来源: 题型:实验题
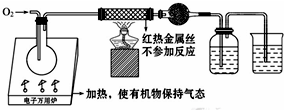 一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示: .
.| 物质种类 | 实例(写结构简式) |
查看答案和解析>>
科目: 来源: 题型:实验题
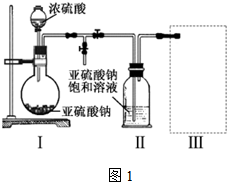
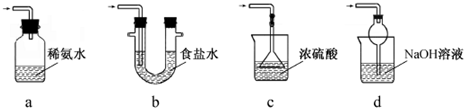

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:1 | ||
| C. | 该有机物可能为烃 | D. | 此有机物的最简式为CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com