
科目: 来源: 题型:解答题
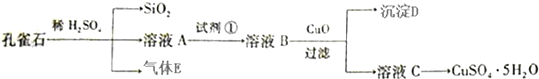
查看答案和解析>>
科目: 来源: 题型:填空题
 )和新
)和新 ) ⑤
) ⑤ 和
和 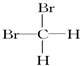 ⑥甲烷和丙烷
⑥甲烷和丙烷查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 引起日本水俣病的重金属是镉 | |
| B. | 引起日本痛痛病的重金属是汞 | |
| C. | 水体富营养化是因为大量含Na+的肥皂水任意排放造成的 | |
| D. | 改善水质最主要的是控制工业废水和生活污水的排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 名称 | 熔点 | 沸点 | 溶解性 |
| 一氯甲烷 | -97.73℃ | -24.2℃ | 18℃时在水中微溶,与乙醚、丙酮或苯互溶,能溶于乙醇 |
查看答案和解析>>
科目: 来源: 题型:选择题
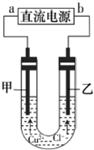
| A. | b端是直流电源的负极 | |
| B. | 用湿润的KI一淀粉试纸检验甲电极产物 | |
| C. | 通电一段时间后,在阴极附近观察到黄绿色气体 | |
| D. | 若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用电解法精炼铜时,粗铜做阴极 | |
| B. | 电解稀硫酸制O2、H2时,铜做阳极 | |
| C. | 在镀件上电镀铜时,可用金属铜做阳极 | |
| D. | 在电解池中,铜做阳极时,溶液中的阴离子在铜极上失电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
| 间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易溶 |
| 2-硝基-1,3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
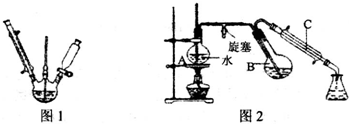
查看答案和解析>>
科目: 来源: 题型:解答题
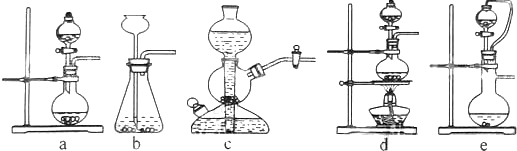
查看答案和解析>>
科目: 来源: 题型:解答题
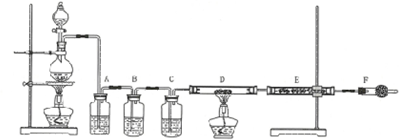 过量的锌与浓硫酸作用的全过程中产生的气体可能有多种.有人认为气体中可能有SO2,也可能有H2.为了说明这两种气体的有无,设计了如图所示的实验装置.
过量的锌与浓硫酸作用的全过程中产生的气体可能有多种.有人认为气体中可能有SO2,也可能有H2.为了说明这两种气体的有无,设计了如图所示的实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com