
科目: 来源: 题型:填空题
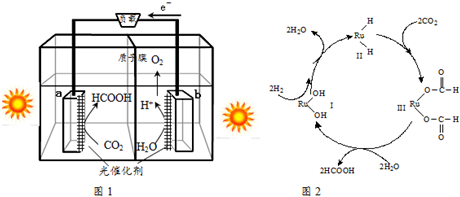
查看答案和解析>>
科目: 来源: 题型:推断题



 的路线如下:
的路线如下:
 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 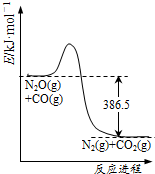 由图可判断该反应的正反应为放热反应 | |
| B. | 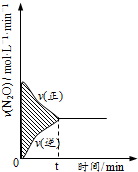 由图可判断阴影部分面积的数值为0.05 | |
| C. | 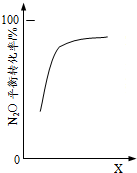 由图可判断横坐标X可能是压强 | |
| D. |  图研究的是不同催化剂对反应的影响,则甲使用的催化剂效率较高 |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 化合物X、Y、Z中均有一个手性碳原子 | |
| B. | ①、②、③的反应类型依次为加成反应、还原反应和取代反应 | |
| C. | 由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热 | |
| D. | 化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该电池总反应为:4NH3+3O2═2N2+6H2O | |
| B. | a极的电极反应为:2NH3-6e-═N2+6H+ | |
| C. | b极的电极反应为:4OH--4e-═2H2O+O2↑ | |
| D. | a极每产生1molN2,约有6×6.02×1023个OH-迁移至b极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 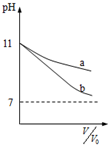 图可表示体积均为V0L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水 | |
| B. | 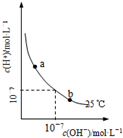 图可表示水溶液中H+与OH-的浓度变化曲线,则升高温度可实现a→b | |
| C. | 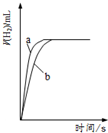 图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与0.003gZn反应,则a表示盐酸 | |
| D. | 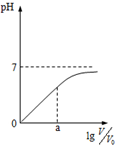 图可表示体积为V0L1 mol•L-1盐酸用水稀释至VL情况,则0~a范围内:pH=lg$\frac{V}{{V}_{0}}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应C(s)+H2O(g)?CO(g)+H2(g) 的平衡常数为:K=$\frac{c(CO)•c({H}_{2})}{c(C)•c({H}_{2}O)}$ | |
| B. | 反应Cr2O72-+H2O?2CrO42-+2H+ 的平衡常数为:K=$\frac{c(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{3}^{2-})•c({H}_{2}O)}$ | |
| C. | NH4++H2O?NH3•H2O+H+的平衡常数为:K=$\frac{{K}_{W}}{{K}_{b}(N{H}_{3}•{H}_{2}O)}$ | |
| D. | 2AgI(s)+S2-(aq)?Ag2S(s)+2I-(aq)的平衡常数为:K=$\frac{{K}_{sp}(A{g}_{2}S)}{{{K}_{sp}}^{2}(AgI)}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硝酸银标准溶液滴定含氯离子的溶液[Ag++Cl-═AgCl↓] | |
| B. | 盐酸标准溶液滴定氨水[H++NH3•H2O═NH4++H2O] | |
| C. | Na2S2O3标准溶液滴定含单质碘的溶液[I2+2Na2S2O3(无色)═Na2S4O6 (无色)+2NaI] | |
| D. | 酸性高锰酸钾标准溶液滴定草酸溶液[2MnO4-+5H2C2O4+6H+═2Mn2+(无色)+10CO2↑+8H2O] |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com