
科目: 来源: 题型:选择题
| A. | $\stackrel{234}{92}$U和$\stackrel{238}{92}$U | B. | CO2和干冰 | C. | CH4和CH3CH2CH3 | D. | 正丁烷和异丁烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 从海水中提炼出的氘(含 HDO 0.03‰)进行核聚变,放出巨大的能量以解决能源问题, 成为一条新的科学思路.HDO与 H2O化学性质相同 | |
| B. | 从海水中提取镁可以采用下列方法:海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{HCl}{→}$MgCl2溶液→MgCl2•6H2O$→_{△}^{HCl}$MgCl2(熔融)$\stackrel{电解}{→}$Mg | |
| C. | 从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,已知该化合物中碘元素呈+3和+5两种价态,则这种化合物的化学式是 I4O9 | |
| D. | 除去粗盐中的 SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 体系总压强不再随时间而改变 | B. | 体系总质量不再随时间而改变 | ||
| C. | NO(g)和 NO2(g)的生成速率相同 | D. | SO3 (g)和 NO(g)的浓度比为 1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | 20℃ | 铁片 | 1mol/L硫酸 | B | 30℃ | 铁粉 | 1mol/L稀硫酸 |
| C | 30℃ | 铁粉 | 2mol/L稀硫酸 | D | 30℃ | 铁片 | 2mol/L稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
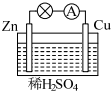 如图所示是 Zn和 Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )
如图所示是 Zn和 Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )| A. | ①②③ | B. | ②④⑥ | C. | ③④⑤ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu与浓硝酸反应比与稀硝酸反应快 | |
| B. | Cu能与浓硝酸反应,而不与浓盐酸反应 | |
| C. | Cu与浓硫酸能反应,而不与稀硫酸反应 | |
| D. | N2与 O2在常温、常压下不反应,放电时可反应 |
查看答案和解析>>
科目: 来源: 题型:实验题
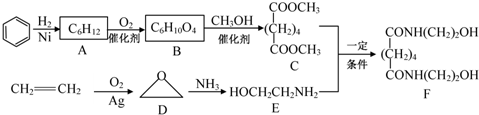
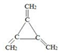
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com