
科目: 来源: 题型:选择题
| A. | 300mL0.1mol•L-1Na2SO4溶液中Na+浓度为0.6mol•L-1 | |
| B. | 标准状况下,22.4LH2O所含原子数为3NA | |
| C. | 1molH3O+中所含有电子数为10NA | |
| D. | 0.2mol•L-1Ba(NO3)2溶液中NO${\;}_{3}^{-}$离子数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 取样品,向其中滴加石蕊试液 | B. | 取样品,向其中加入CaCO3粉末 | ||
| C. | 取样品,向其中滴加Ba(NO3)2溶液 | D. | 取样品,向其中滴加Na2CO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molH2中的氢原子数 | B. | 1molOH-中的电子总数 | ||
| C. | 1molHNO3中的氧原子数 | D. | 1molH2SO4溶于水后的离子总数 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 150mL,1mol•L-1 的NaCl | B. | 100mL,2mol•L-1 的MgCl2 | ||
| C. | 100mL,1mol•L-1 的FeCl3 | D. | 50mL,3mol•L-1 的FeCl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molMg变成Mg2+时失去的电子数为NA | |
| B. | 标准状况下,22.4L氮气含有的氮原子数为NA | |
| C. | 48gO3所含氧原子数为3NA | |
| D. | 18gH2O中所含的电子数我8NA |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题

 .分别写出②和⑦、③和⑧化合产物的电子式
.分别写出②和⑦、③和⑧化合产物的电子式 、
、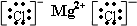 .⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).
.⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).查看答案和解析>>
科目: 来源: 题型:填空题
 氢氧燃料电池的原理如图所示:回答下列问题
氢氧燃料电池的原理如图所示:回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com