
科目: 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应①②中的氧化剂分别是Sb2S3、Sb4O6 | |
| B. | 反应①中每生成3molFeS时,共转移6mol电子 | |
| C. | 反应②说明高温下Sb的还原性比C强 | |
| D. | 每生成4molSb时,反应①与反应②中还原剂的物质的量之比为3:4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲酸甲酯的结构简式:C2H4O2 | B. | H2O2的电子式: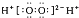 | ||
| C. | 中子数为10 的氧原子:188O | D. | 对-硝基甲苯的结构简式: |
查看答案和解析>>
科目: 来源: 题型:填空题
 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
科目: 来源: 题型:填空题
 ;
;查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
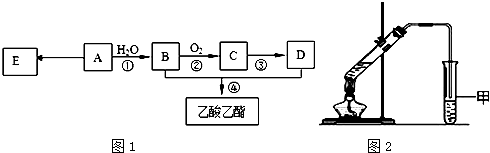
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com