
科目: 来源: 题型:填空题
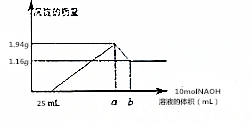 将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题:
将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH≡CH+H2O $→_{△}^{HgSO_{4}}$CH3CHO | |
| B. | C2H5Br+H2O $→_{△}^{NaOH}$ C2H5OH+HBr | |
| C. | CaC2+2H2O→Ca(OH)2+C2H2↑ | |
| D. | CH3COOCH3+H2O$→_{△}^{催化剂}$CH3COOH+CH3OH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| B. | 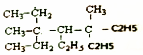 进行一氯取代反应后,能生成6种沸点不同的产物 进行一氯取代反应后,能生成6种沸点不同的产物 | |
| C. | 正戊烷分子中所有的碳原子均在一条直线上 | |
| D. | 分子式为C3H6、C6H12的两种有机物一定是同系物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 维生素C具有还原性,能在人体内起抗氧化作用 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 糖类是产生能量最高的营养物质 | |
| D. | 废电池必须进行集中处理的首要原因是回收利用石墨电极和金属材料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可以收集到标准状况下氯气5.6bcL | |
| B. | 反应后Cl-数目为bc-d | |
| C. | NA可表示为$\frac{2a}{87d}$ | |
| D. | 反应后溶液中的H+的物质的量为(bc-$\frac{2d}{{N}_{A}}$)mol |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
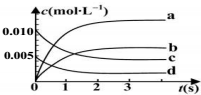 在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目: 来源: 题型:填空题


 ,青蒿素分子式为C15H22O5.
,青蒿素分子式为C15H22O5.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com