
科目: 来源: 题型:实验题
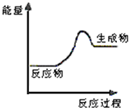 现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C10H9Cl3O2 | B. | C10H9Cl2O2 | C. | C10H12Cl3O2 | D. | C10H17Cl3O2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
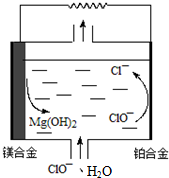
| A. | Mg-Li合金比传统的Mg-Al合金具有更高的比能量 | |
| B. | 铂合金的电极反应:ClO-+H2O═Cl-+2OH--2e-,OH-向镁合金电极迁移 | |
| C. | 该电池镁合金会发生自身腐蚀产生氢气,使电极利用率降低 | |
| D. | 把电解质换成H2O2、H2SO4和NaCl的混合溶液,工作时H2O2将参与电极反应,其电极反应为:2H2O2-2e-═O2↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | 开始沉淀 | 沉淀完全 |
| Zn2+ | 5.7 | 6.2 |
| Mn2+ | 8.2 | 9.7 |
查看答案和解析>>
科目: 来源: 题型:实验题
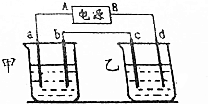 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
科目: 来源: 题型:解答题
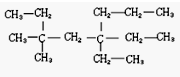
查看答案和解析>>
科目: 来源: 题型:解答题
| 符号 | 质子数 | 电子数 |
| 1 | 0 | |
| NH4+ | ||
| Mn- | b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com