
科目: 来源: 题型:推断题
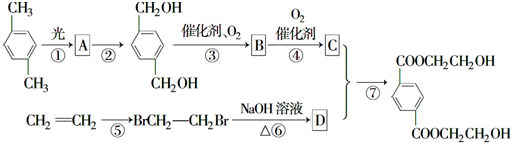
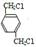 ,B
,B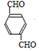 ,
,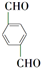 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$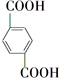
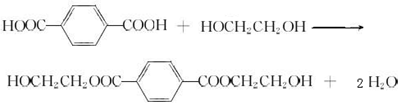
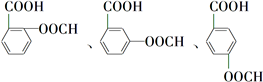 .
.查看答案和解析>>
科目: 来源: 题型:推断题
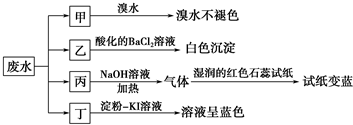
| 阳离子 | Na+、Mg2+、X |
| 阴离子 | Cl-、SO32-、Y、NO3- |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 18 g | B. | 24 g | C. | 30 g | D. | 36 g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100 mL浓度为2 mol•L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 丙烯的结构简式为CH2CHCH3 | |
| B. | 新戊烷的二氯代物有2种 | |
| C. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| D. | 键线式为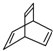 的有机物的分子式为C8H10 的有机物的分子式为C8H10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用石墨作电极电解CuSO4溶液,通电一段时间后,在标准状况下两极产生的气体可能相等 | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 电解池中的阳极和原电池中的负极上都发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
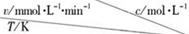 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=7.50 | |
| B. | 同时改变反应温度和蔗糖的浓度,v可能不变 | |
| C. | b>318.2 | |
| D. | 温度为b时,蔗糖浓度减少一半所需的时间比318.2K时短 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com