
科目: 来源: 题型:实验题
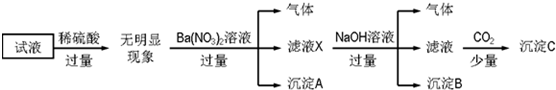
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 电解熔融氧化铝:2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ | |
| C. | NaHCO3溶液与稀H2SO4反应:HCO3-+H+═H2O+CO2↑ | |
| D. | 向Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ①②④⑤ | C. | ①②③④ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| B. | Al2O3熔点高,可用作耐高温材料 | |
| C. | 铁比铜金属性强,可用FeCl3腐蚀Cu刻制印刷电路板 | |
| D. | NaHCO3溶于水呈碱性,可作抗酸药,服用时喝些醋能提高药效 |
查看答案和解析>>
科目: 来源: 题型:解答题
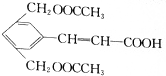 )在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题:
)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题: CH3COOCH2CH3+H2O,该反应的反应类型是酯化(取代)反应
CH3COOCH2CH3+H2O,该反应的反应类型是酯化(取代)反应 (任写一种).
(任写一种).查看答案和解析>>
科目: 来源: 题型:解答题
 )是显影技术中的中间体.回答下列问题:
)是显影技术中的中间体.回答下列问题: .
.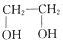 )可合成环酯,该反应的化学方程式为
)可合成环酯,该反应的化学方程式为 +
+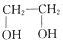 $→_{△}^{浓H_{2}SO_{4}}$2H2O+
$→_{△}^{浓H_{2}SO_{4}}$2H2O+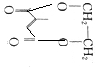 .
.查看答案和解析>>
科目: 来源: 题型:实验题
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa、25℃时,16gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ.N2H4完全燃烧反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa、25℃时,16gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ.N2H4完全燃烧反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com