
科目: 来源: 题型:实验题
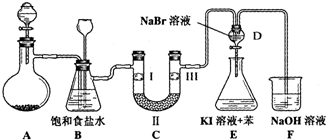
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目: 来源: 题型:实验题
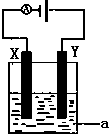 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1查看答案和解析>>
科目: 来源: 题型:实验题
 研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | 先变红后褪色 |
| b | AgNO3溶液 | 出现白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 上述反应中金属共失去电子0.1mol | |
| B. | 合金中,铜的质量为2.8g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5mol•L-1的NaOH溶液60mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 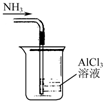 吸收NH3制取Al(OH)3 | |
| B. | 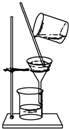 在不断搅拌下分离Al(OH)3和NH4Cl溶液 | |
| C. | 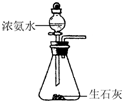 制取NH3 | |
| D. |  蒸干NH4Cl溶液并灼烧制NH4Cl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 | |
| D. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$ K↑+NaCl) |
查看答案和解析>>
科目: 来源: 题型:推断题
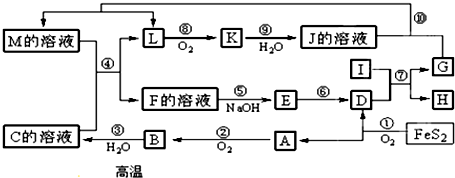
查看答案和解析>>
科目: 来源: 题型:实验题
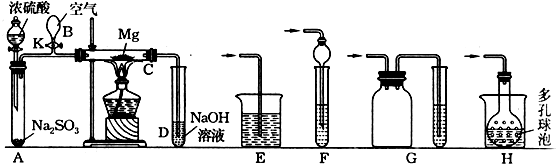
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com