
科目: 来源: 题型:填空题
 已知尿素(结构简式:
已知尿素(结构简式: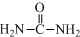 )可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.回答下列问题.
)可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.回答下列问题.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 降低温度可以缩短反应达到平衡的时间 | |
| B. | 恒容时通入氩气,压强增大,平衡向右移动 | |
| C. | 恒容时通入X2,平衡向正反应方向移动,平衡常数不变 | |
| D. | 恒温恒压下,若混合气体密度不变,说明反应已达平衡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度和减小压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和增大压强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 14 g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:填空题
 碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯和液溴用溴化铁作催化剂生成溴苯 | |
| B. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 | |
| C. | 银氨溶液配制后加入稀硝酸使溶液呈酸性,再滴入乙醛溶液共热,有银镜生成 | |
| D. | 加氢氧化钠钠溶液,充分振荡,分液可除去乙酸乙酯中的乙酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 降低温度可加快该反应速率 | |
| B. | 加入合适的催化剂可提高该反应速率 | |
| C. | 达到平衡时,v(正)=v(逆)=0 | |
| D. | 达到平衡时,H2O2转化率为100% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol•L-1,则H2的反应速率为0.03 mol•(L•min-1) | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液中恰好反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com